Les entérotoxines staphylococciques sont des protéines excrétées par certains staphylocoques, elles sont formées dans l’aliment lors de la préparation des repas et demeurent une cause majeure des contaminations humaines d’origine alimentaire. La surveillance et la caractérisation fine des populations bactériennes productrices de ces toxines sont précieuses pour mieux prévenir les intoxinations. Nous faisons ici le point sur les entérotoxines staphylococciques et les points clés de leur surveillance.
Les TIAC à Staphylocoques
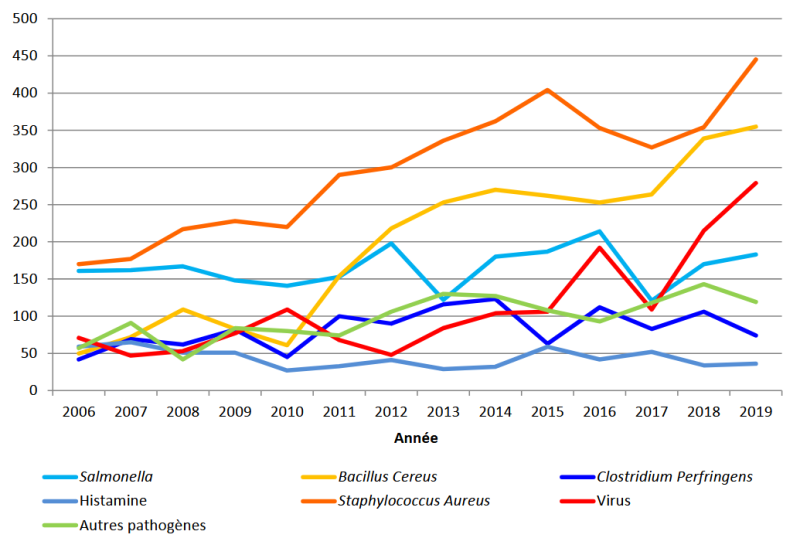
Les staphylocoques (et leurs entérotoxines) représentent la première cause des toxi-infections alimentaires collectives (TIAC à agent confirmé ou suspecté) en France et constituent une des causes majeures des maladies d’origine alimentaires au niveau mondial [ 1 ]. Les TIAC à staphylocoques sont dues à l’ingestion d’entérotoxines staphylococciques (ES) thermorésistantes, préformées dans l’aliment au moment de leur préparation. La grande majorité de ces TIAC a lieu en restauration, cantine scolaire ou en milieu familial. Pour rappel, une TIAC est définie par l’apparition d'au moins deux cas d'une symptomatologie similaire, en général gastro-intestinale, dont on peut rapporter la cause à une même origine alimentaire. Les staphylocoques et les ES sont le plus souvent détectés dans les échantillons alimentaires et plus rarement dans les vomissements et les coprocultures des malades [ 1 ]. Très souvent, seules les ES sont détectées dans les aliments contaminés; les souches bactériennes productrices de ces toxines ayant été éliminées par les conditions de préparation. Il est donc parfois difficile de relier les ES aux souches productrices. La détection des ES dans les aliments est donc une étape cruciale pour la surveillance des TIAC à staphylocoques.
La surveillance des TIAC à staphylocoques
Depuis 1987, la surveillance des intoxinations staphylococciques est assurée par la déclaration obligatoire des TIAC auprès de l’Agence régionale de santé (ARS) et/ou de la Direction départementale en charge de la protection des populations (DDecPP). Les déclarations reçues sont transmises à la Mission des urgences sanitaires (MUS) de la Direction générale de l’alimentation (DGAL). La déclaration peut également être faite par des consommateurs. Cependant de nombreux foyers, notamment familiaux, sont probablement non déclarés ou non diagnostiqués [ 1 ]. Les cas sont déclarés en fonction du diagnostic clinique (nausées, vomissement en fusée, douleurs abdominales sans fièvre). La durée des symptômes varie entre quelques heures et deux jours. Il est à noter que les agents toxigéniques à durée d’incubation courte (S. aureus, Bacillus cereus) présentent des caractéristiques très proches en terme de durée d’incubation et de symptômes, les données doivent donc être interprétée avec précaution. En 2019, Staphylococcus aureus a été suspecté dans 428 foyers de TIAC, soit 39% des foyers de TIAC déclarés en France ce qui représente 2 369 personnes malades dont 89 hospitalisées. Cet agent pathogène n’a été confirmé que dans 17 foyers.
Staphylococcus et entérotoxines
Les ES sont produites par les staphylocoques toxinogènes pendant leur croissance. Ces toxines sont formées dans les aliments contaminés par des staphylocoques toxinogènes. La production de toxines nécessite une concentration bactérienne supérieure à 105 cellules/g d’aliment. Les ES sont produites entre 6.7°C et 45.5°C, elles résistent à la chaleur et à l’action d’enzymes digestives. Elles sont détruites par chauffage pendant au moins 30 minutes à 100°C. Les staphylocoques, quant à eux, ne résistent pas à des traitement thermiques supérieurs à 60°C appliqués pendant plus de 60 minutes [ 2 ]. S. aureus (ou staphylocoque doré) est l’espèce la plus souvent incriminée dans les TIAC et la plus pathogène du genreStaphylococcus. D’autres espèces toxinogènes comme S. hyicus, S. intermedius ou S. argentus [ 3 ] (récemment identifiée comme une nouvelle espèce dissociée de S. aureus) [ 4 ], ont été impliquées dans des TIAC, mais leur présence dans les aliments reste très peu documentée. Ces bactéries sont également dites “à coagulase positive” (SCP) pour indiquer leur capacité à produire une enzyme qui coagule le plasma et procure un effet protecteur à la bactérie. Certains staphylocoques ne produisant pas de coagulase seraient également toxinogènes [ 5 ] mais leur implication dans les TIAC n’a pas été prouvée.
Les staphylocoques sont des bactéries ubiquitaires, les TIAC sont généralement liées à la contamination des aliments et/ou au non respect des mesures d'hygiène et des températures (rupture de la chaîne du froid et du chaud) lors de la préparation des aliments [ 6 ]. Tous les aliments et les préparations alimentaires pouvant permettre la croissance de SCP et la production d’ES peuvent être suspectés dans les TIAC, notamment les aliments riches en protéines, d’un pH proche de la neutralité ou présentant une faible flore microbienne annexe. Plus de 30 ES ont été décrites, parmi elles, seulement cinq sont détectables par des kits commerciaux : SEA, SEB, SEC, SED et SEE, la toxine SEA étant la plus fréquemment suspectée dans les TIAC. Outre ces cinq toxines, la toxicité des autres ES et leur implication dans les épidémies d’origine alimentaire est encore à l’étude [ 7 ]. Les ES agissent d’une part, via l’activation des récepteurs de la paroi cellulaire à l’image des neurotoxines et d’autre part, comme de supers antigènes reconnus par le système immunitaire. La dose ingérée provoquant les symptômes est encore assez mal définie, elle peut être très basse, de l’ordre de 20 à 144 ng de ES par prise alimentaire et elle varie en fonction des ES (moins de 6,1 ng pour ES type A (SEA)) [ 8 ]. Il est donc indispensable d’avoir des méthodes de détection des ES très performantes. Cependant, les ES nouvellement décrites (SEG, SEH, SEI, SEM, SEN, SEO, SER, SEJ, SES, SET) produites par S. aureus pourraient être également responsables de TIAC [ 8 ]. De récents travaux ont mis en évidence un îlot génomique (vSaβ) portant les gènes (cluster egc) codant pour les toxines SEG, SEI , SEM, SEN, SEO, SEU, cet îlot génomique serait présent sous différents types, dans environ 50% des génomes de S. aureus [ 9 ].
La surveillance des ES et S. aureus dans les aliments
Le Règlement (CE) n°2073/2005 modifié [ 10 ] s’applique à la recherche des SCP et des ES dans les denrées alimentaires. Ce règlement concerne les critères microbiologiques applicables aux denrées alimentaires, il définit deux types de critères microbiologiques pour ces dangers: un critère d’hygiène des procédés qui s’applique aux laits, produits laitiers ou encore aux mollusques coquillages et crustacés pendant le procédé de fabrication ; un critère de sécurité qui s’applique à ces produits lorsque le critère d’hygiène n’est pas respecté, dans ce cas les produits doivent faire l'objet d'une recherche des ES pour prouver leur non détection (dans 25g). Les autres filières concernées s’appuient sur les guides sectoriels de bonnes pratiques et d’application des principes HACCP (GBPH), destinés aux fabricants d'aliments, aux éleveurs, engraisseurs, transporteurs, abattoirs, etc… Ces filières sont également soumises aux plans annuels de surveillance et de contrôle (PSPC) coordonnés par la DGAL. Le dénombrement des S. aureus se fait suivant les normes NF EN ISO 6888-1 et -2. La détection des toxines de types SEA à SEE se fait selon la norme NF EN ISO 19020, utilisant des outils de type immunochimiques qualitatifs mis en œuvre après extraction et concentration par dialyse. Outre les méthodes normalisées, trois types de méthodes sont utilisées pour détecter les ES et les bactéries toxinogènes : les tests immunologiques, la biologie moléculaire et la spectrométrie de masse [ 11 ]. Ces méthodes présentent des limites liées à la matrice alimentaire (isolement des souches, interférence avec la matrice alimentaire). Les tests immunologiques sont les plus utilisés, des kits commercialisés depuis plus de 15 ans permettent la détection des ES de type SEA à SEE, le lot est considéré comme impropre à la consommation dès l’obtention d’un résultat positif par la méthode de détection utilisée. De nouvelles méthodes immunologiques et de spectrométrie de masse sont en cours de développement pour détecter ces toxines et évaluer leur niveau d’expression qui peut varier d’une souche de S. aureus à l’autre. En parallèle, différentes études ont permis de relier le type de ES au profil moléculaire des souches de S. aureus responsables de TIAC [ 12 ] [ 5 ] [ 7 ].
Comment mieux surveiller pour mieux prévenir ?

Les souches de S. aureus présentent une grande diversité génétique. Les nouvelles techniques de typage moléculaire permettent de comparer les génomes bactériens impliqués dans une TIAC à ceux des souches précédemment associées à un environnement, une espèce animale ou à l’homme et ainsi aider à l’identification de la source de contamination. L’utilisation du séquençage du génome complet (WGS) améliore la caractérisation des génomes des SCP, des profils de virulence, et à terme la compréhension des mécanismes moléculaires de régulation de l’expression des gènes d’ES, et des supports génétiques influençant le transfert horizontal de ces gènes. Le niveau d’expression des gènes dépend également de l’environnement cellulaire, une meilleure compréhension des facteurs environnementaux affectant la croissance des SCP et la production des ES dans les aliments pourrait améliorer la fiabilité des modèles prédictifs d’évaluation des risques de contamination des aliments par S. aureus, tout au long de la chaîne alimentaire [ 13 ]. Ces connaissances reposent sur le développement de techniques de détection qualitatives et quantitatives. Des projets de recherches sont actuellement en cours au niveau européen (Tox-Detect) et national pour valider les techniques de typage moléculaire, spectrométrie de masse et des immuno-essais [ 14 ] [ 8 ].