Arcobacter spp. sont des bactéries potentiellement pathogènes pour l’Homme, selon les gènes de virulence qu’elles détiennent dans leur génome. La description de situations de contamination humaine d’origine alimentaire par les Arcobacter s’amplifie ces dernières années. Nous faisons ici le point sur ce genre bactérien, son éventuelle émergence et les facteurs de risques associés.
Des bactéries proches des Campylobacter, potentiellement pathogènes
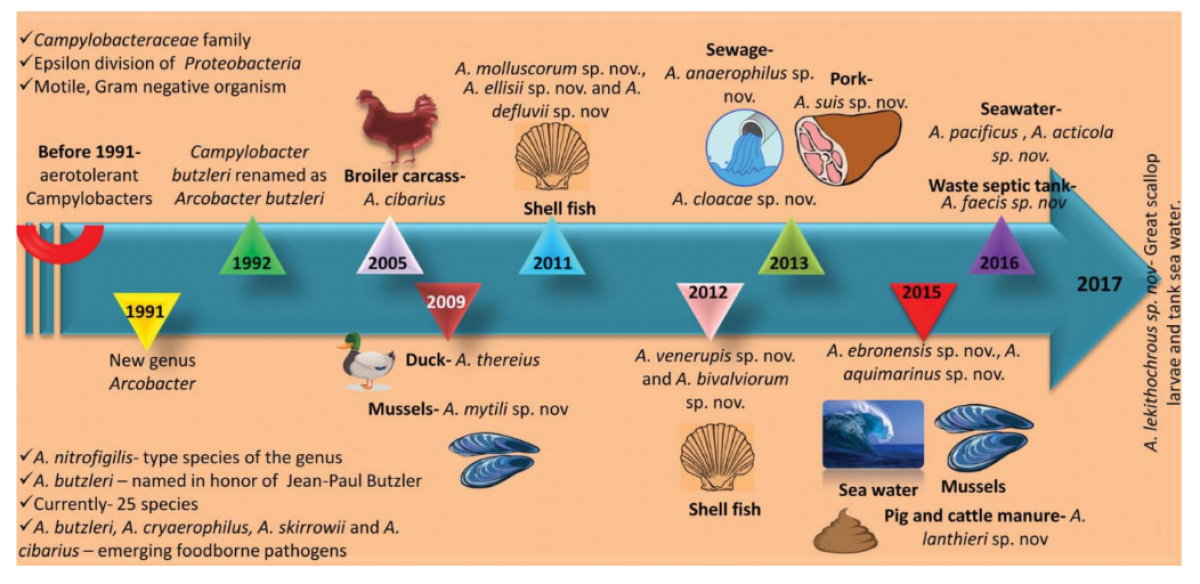
Les bactéries du genre Arcobacter (famille des Campylobacteriaceae) sont des bactéries à Gram négatif, en forme de bâtonnets, légèrement courbées, non sporulantes. Initialement décrites en 1991 et considérées comme des “ Campylobacter aérotolérants”, ces bactéries ont finalement été distinguées du genre Campylobacter par leur capacité à croître à de plus faibles températures que ce dernier. Ces bactéries de 0,2 à 0,9 µm de large pour 1 à 3 µm de long sont mobiles, elles possèdent un unique flagelle polaire [1]. Plus de 30 espèces sont recensées à ce jour au sein du genre Arcobacter, plus d’un tiers ont été décrites depuis 2015 [2] (Figure 1). Face à la grande diversité génétique des Arcobacter, la taxonomie de ce genre bactérien a été réévaluée par analyses phylogénétiques en 2018 et une nouvelle taxonomie a été proposée [3].
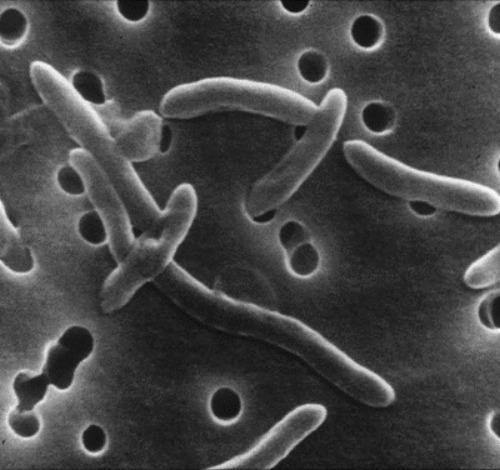
Trois espèces ont été associées à des cas humains : A. butzleri ( Figure 2), A. cryaerophilus et A. skirrowii. Plusieurs gènes de virulence ont été identifiés dans le génome des Arcobacter : cadF, HecA et cj1349 impliqués dans l’adhésion bactérienne, ciaB dans l’invasion, hecB, tlyA et pldA dans la lyse des érythrocytes, irgA dans l’acquisition de fer et le maintien de l’infection ou encore mviN dans la biosynthèse du peptidoglycane [1]. Les souches de l’espèce A. butzleri possèdent généralement une plus grande diversité des gènes comparativement aux autres espèces étudiées. Ces gènes (particulièrement ciaB, mviN, tlyA et pldA) ont été identifiés dans des souches isolées chez les bovins, porcs, volailles et chez l’Homme. Le caractère ubiquitaire de cette bactérie semble bien établi et ce dans toutes les régions du globe où les Arcobacter ont été isolées : dans les milieux aquatiques et terrestres, chez les animaux sauvages, domestiques ou de compagnie, dans des aliments d’origine animale ou végétale, dans l’eau, chez l’Homme [1] [4].
Les Arcobacter sont responsables de gastro-entérites humaines
Les cas sporadiques et épidémiques d’infection humaine à Arcobacter, décrits dans la littérature, étaient associés à des gastro-entérites et plus rarement à des bactériémies. Contrairement à Campylobacter potentiellement responsable de diarrhées sanglantes, les Arcobacter provoquent des diarrhées aqueuses et persistantes chez l’Homme. Les populations particulièrement sensibles sont notamment les enfants, les patients diabétiques (de type 1). La dose infectante n’est pas connue à ce jour [1].
Les Arcobacter spp ont été détectés dans 14 des 2139 coprocultures analysées au centre hospitalier régional (CHR) d’Orléans durant l’année 2019, comparativement aux 21 et 79 coprocultures détectées contaminées respectivement par Salmonella et Campylobacter. Les patients infectés étaient à 57 % des hommes et 43 % des femmes, l’âge médian était de 52 ans (IC95% [1 ; 91]). Les symptômes déclarés étaient des diarrhées, vomissements, douleurs abdominales et fièvres. Le taux de résistance aux bêtalactamines (amoxicilline et amoxicilline-acide clavulanique) des Arcobacter détectés dans l’étude du CHR était supérieur à celui des Campylobacter [5]. A. butzleri arrive en troisième position des bactéries reçues annuellement au CNR des Campylobacters isolées de prélèvements de selles en France [6].
Les Arcobacter sont, à l’origine, sensibles à l’ampicilline, aux aminoglycosamines, à la tétracycline et à l’érythromycine qui est la classe d’antibiotique de choix pour traiter les gastro-entérites dues à ce pathogène. Des résistances acquises aux fluoroquinolones sont possibles chez A. butzleri et A. cryaerophilus [7].
Quelles méthodes pour les détecter et les caractériser ?
Il n’existe pas à ce jour de méthode officielle pour rechercher les Arcobacter, quel que soit le type de matrice à analyser. Les méthodes culturales demeurent le gold standard pour les détecter. Ces bactéries requièrent une culture en microaérobie (condition optimale : 3 à 10 % d’O2), à l’exception de A. anaerophilus qui peut croître en anaérobie stricte. Plusieurs milieux chromogéniques et bouillons d’enrichissement existent. Une étape de pré-enrichissement est recommandée par certains auteurs selon la matrice à analyser. La limite de détection d’une méthode appliquée au lait cru a été estimée à 100 CFU/ml [8]. Des méthodes moléculaires plus sensibles, plus rapides et spécifiques sont développées depuis plusieurs années : PCR multiplex (par exemple pour détecter simultanément la présence de A. butzleri, A. cryaerophilus, A. skirrowii) et/ou temps réel, RFLP, Maldi-Tof, DGGE-PCR, FISH, PCR nichée [ 1 ]. Ces méthodes permettent de détecter, confirmer, différencier ou génotyper les Arcobacter. Des génomes entièrement séquencés sont déjà disponibles pour certaines espèces du genre. Par approche méta-génomique, les bactéries présentes dans l’eau et des sédiments du Gange ont été caractérisées et ont montré une diffusion corrélée de gènes de résistance aux antibiotiques ou de résistance aux ions métalliques [9]. Arcobacter est apparu parmi les quatre genres bactériens les plus représentés et le plus fréquent dans les sédiments. Ces gènes de résistance et l’avantage sélectif qu’ils procurent seraient-ils à l’origine de l’émergence de ce danger bactérien ? Serait-ce le seul facteur en jeu ?
La diversité génétique des Arcobacter , reflet d’une multitude de sources de contamination ?
La capacité de A. cryaerophilus à pénétrer l’intestin et le placenta de la truie a été démontrée, engendrant une possible transmission verticale de l'agent pathogène à la descendance. La transmission horizontale est cependant plus probable. Un portage très majoritairement asymptomatique d’Arcobacter spp a été démontré en filières aviaire, porcine, bovine et ovine avec des taux compris entre 2 et 9 CFU/g de fèces. Les souches isolées présentaient une grande diversité d'espèces. Des cas d’avortement (A. thereius) et de gastro-entérites (A. butzleri) ont été rapportés en filière porcine. Chez les bovins, A. butzleri, A. cryaerophilus, A. skirrowii ont provoqué des entérites, ou encore des diarrhées et colites hémorragiques comme chez les brebis (A. skirrowii uniquement). Les facteurs de risque de colonisation du tube digestif de ces animaux et l’impact des mesures de biosécurité sur la présence des Arcobacter restent peu étudiés. A l’abattoir, rien de nouveau : l’éviscération est l’étape clé à maîtriser pour éviter les contaminations. Une étude a permis d’observer des contaminations de carcasses de porc de l’ordre de 2 Log CFU/100 à 300 cm². La poitrine et les pattes avant sont les pièces les plus fréquemment contaminées [4].
Quelles sont les sources alimentaires potentielles connues ?
(Manke and Dickinson, 1996).
Dans les pays dits développés, les sources alimentaires à l’origine d’infections humaines à Arcobacter sont principalement l’eau et des aliments crus ou peu transformés. La capacité de ces bactéries à adhérer à des surfaces en acier inoxydable et en plastique, de croître à 10°C et à former des biofilms leur confère tous les atouts pour diffuser le long de la chaîne alimentaire. Leur détection en production primaire et à l’abattoir s’inscrit en cohérence avec les travaux cités ci-après. A. butzleri a été identifié (par Maldi-Tof et PCR multiplex) dans le lait d’exploitations bovines du Piedmont (Italie) en 2018. Le lait de ces élevages, mis à la vente directe aux consommateurs par l’intermédiaire de distributeurs automatiques, a également été détecté contaminé. Au total, 37 prélèvements de lait issus de 24 fermes ont été analysés et 4/12 échantillons de lait de tank, ainsi que 4/25 échantillons de lait de distributeur ont révélé la présence de A. butzleri [8].
Les taux de contamination du lait cru de bovin varient (3 à 80 %) selon les pratiques d’élevages et les protocoles d’échantillonnages et analytiques qui ne sont pas harmonisés. L’eau est apparue comme une source majeure de transmission de ces bactéries entre des bovins laitiers et leur environnement, parmi une grande diversité de sources [10]. Plusieurs études laissent supposer une plus grande capacité d’A. butzleri, comparativement aux autres espèces d’ Arcobacter, à survivre dans les environnements de production des élevages laitiers. Une étude par contamination artificielle post-fabrication a montré la capacité de A. butzleri et A. cryaerophilus à survivre à 6°C et croître à 12°C dans la ricotta, qu’il s’agisse d’un fromage (pH>6 ; aw>0,98-0,99) artisanal (Durée de vie (DdV) = 5 j.) ou industriel (DdV = 22 j.) [11].
Les prévalences de contamination par les Arcobacter spp, observées par quelques rares études dans les végétaux prédécoupés, prêts à consommer, sont de l’ordre de 20 % à 35 %. Ces produits respectaient par ailleurs les critères microbiologiques d’hygiène fixés par la réglementation européenne (Règlement N°2073/2005 modifié). Une étude menée entre février et septembre 2015, en supermarché dans le Sud-Est de l’Italie, a révélé un taux de contamination de 27,5 % (n=44/160) des végétaux échantillonnés (laitues, épinards, roquette et valériane). Seuls A. butzleri (n=40) et A. cryaerophilus (n=4) ont été détectés ; leur caractérisation moléculaire a révélé une large distribution des gènes de virulence déjà connus. La saisonnalité d’isolement des Arcobacter observée (supérieure en été) pourrait s’expliquer par un manque de respect de la chaîne du froid appliquée à ces produits [12].
Une étude italienne a été menée en Sardaigne en 2016-2017 pour estimer la prévalence des Arcobacter dans les mollusques bivalves prélevés à la vente ou à la production : sur fonds sablonneux pour les palourdes et en eaux saumâtres ou dans des fermes marines - systèmes suspendus - pour les moules et huîtres. Les prévalences observées étaient respectivement de 40 % (n=10), 29 % (n=59) et 35 % (n=17) avec identification de A. cryaerophilus et A. skirrowii (13 %) et A. butzleri (11 %). Les zones d’élevage prélevées étaient classées Catégorie B, selon la réglementation européenne et le critère microbiologique d’hygiène basé sur la détection des E. coli. Des études complémentaires sur différents mollusques bivalves comestibles sont nécessaires pour évaluer l'efficacité des pratiques de purification sur l'élimination d'Arcobacter spp. et la corrélation entre la présence d'E. coli et d'Arcobacter spp. [13].
Mieux surveiller et caractériser pour mieux prévenir le risque
Les souches isolées en filière laitière semblent présenter des pathotypes (selon la présence des gènes de virulence) différents des souches isolées d’autres filières [14]. Quel impact sur la pathogénicité ? Cette observation permettrait-elle d’orienter les investigations lors de futures situations de contamination ? Plusieurs plasmides ont été décrits chez A. butzleri, qui véhiculent des gènes impliqués dans le transfert de matériel génétique et de toxines. De nouvelles souches virulentes du genre Arcobacter pourraient donc voir le jour et amplifier l’émergence de ce genre bactérien. L’exposition de l’Homme à cette bactérie entéropathogène, qui croît à de faibles températures de réfrigération, adhère aux surfaces et résiste à la dessiccation, est probablement sous-estimée. D’autres travaux de recherche et de surveillance sont nécessaires pour mieux comprendre l’écologie et l’épidémiologie associées à cet agent pathogène et évaluer plus précisément son caractère émergent.