Dans le cadre de la surveillance, les analyses relatives à la détection et à la quantification des éléments traces métalliques sont généralement réalisées en dosant l’élément « total ». Pourtant, dans l’environnement comme dans les organismes vivant, un élément peut prendre différentes formes qui impactent directement son assimilation par les êtres vivants et sa toxicité. La connaissance des espèces chimiques en présence, ou spéciation, peut donc s’avérer nécessaire pour déterminer plus précisément les risques liés à l’exposition d’un élément d’intérêt. Nous faisons ici le point sur l’importance de la spéciation des éléments traces métalliques.
Qu’est-ce que la spéciation ?
Au cours des trois décennies qui ont suivi la Seconde Guerre mondiale, les méthodes d’analyse des éléments traces métalliques (ETM) - terme englobant des métaux et des métalloïdes en concentration moyenne inférieure à 1 g/kg dans le sol - se sont considérablement développées. A la fin des années 80, les capacités de détection ont atteint une sensibilité suffisante pour doser diverses espèces chimiques d’un même ETM en faibles quantités dans des matrices environnementales ou biologiques. En parallèle, les travaux de recherche avaient pointé le rôle de la forme chimique des ETM dans leur comportement dans les milieux et leur toxicité. Les analyses de spéciation sont alors devenues un domaine important de la chimie analytique [ 1 ].
En 2000, l’Union Internationale de Chimie Pure et Appliquée (IUPAC), faisant le constat que le terme de « spéciation » était parfois utilisé en chimie pour recouvrir des significations variées, a établi les définitions suivantes :
« Espèce chimique » : forme spécifique d’un élément définie selon sa composition isotopique, sa structure électronique ou son état d’oxydation, sa présence sous forme de complexe et / ou sa structure moléculaire » ;
« Spéciation d’un élément » : répartition des espèces chimiques dans un échantillon ;
« Analyse de spéciation » : activité analytique qui identifie et/ou quantifie les espèces chimiques d’un élément dans un échantillon [ 2 ].
A noter que la spéciation chimique ne se limite pas aux ETM, elle peut aussi concerner les polluants organiques, néanmoins la spéciation des ETM est mieux documentée, ces derniers ayant été davantage étudiés [ 3 ].
Impact sur la toxicité
Les caractéristiques physico-chimiques de l’espèce d’un élément (composition isotopique, état d’oxydation, présence sous forme de complexes etc.) influent sur la capacité de l’élément d’être absorbé par l’organisme, de se fixer à des protéines pour former des ligands, de pénétrer dans le système sanguin (biodisponibilité) puis dans les tissus. Certaines de ces caractéristiques sont plus critiques que d’autres en matière de toxicité. Ainsi, la valence d’un élément – c’est-à-dire le nombre maximal de liaisons que celui-ci peut former en fonction de sa configuration électronique – ou l’existence de liaisons organométalliques covalentes - c’est-à-dire des liaisons formées par un doublet d’électrons liant un atome de métal à un atome de carbone, sont généralement des caractéristiques essentielles [ 4 ].
Quelques exemples
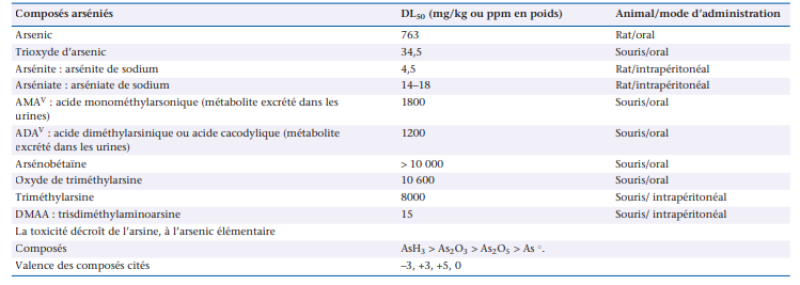
L’arsenic (As) peut exister sous quatre états de valence [(-III), (0), (+III) et (+V) et plus d’une centaine de formes [ 5 ], qu’elles soient inorganiques [l’anhydride arsénieux (As(III) : As2O3), l’anhydride arsénique (As(V) : As2O 5), l’arsine (As(-III) : AsH3 etc.)] ou organiques. Parmi ces dernières, les plus fréquemment retrouvées dans l’alimentation sont l’arsénobétaine (C5H11AsO2) , la famille des arsénoglucides, celle des arsénolipides, ainsi que les formes méthylées de l’arsenic (acide méthylarsonique ou MMA : CH3AsO(OH)2, acide diméthylarsinique ou DMA : (CH 3)2AsOOH etc.). La toxicité de l’arsenic est fortement liée à sa métabolisation. Dans l’organisme, l’arsenic pentavalent (V) est réduit en arsenic trivalent (III). A des concentrations faibles, leur toxicité est donc similaire. Par contre, à forte dose, la rétention des formes trivalentes (As(III)) est plus importante. Pénétrant plus facilement dans les cellules que l’arsenic pentavalent, et étant plus réactif, il est de ce fait plus toxique. Bien qu’il existe des exceptions, les formes inorganiques de l’arsenic ont généralement une toxicité aigüe plus importante que les composés organiques, pouvant varier d’un facteur 300 (cf. Tableau 1).
Tableau 1 : Dose létale médiane (DL50) de l’arsenic élémentaire et de certains composés arséniés minéraux et organométalloïdiques [6]
A faible dose cependant, les formes méthylées trivalentes, très réactives, pourraient présenter des propriétés génotoxiques supérieures à l’arsenic inorganique. [ 6 ; 7 ]. A ce jour, l’arsenic et ses composés inorganiques sont classés cancérogènes avérés pour l’Homme par le CIRC depuis 1980 (groupe 1) tandis que le MMA et le DMA sont classés cancérogènes possibles (groupe 2B), et les autres formes sont inclassables (groupe 3) [ 8 ].
Dans l’alimentation, les denrées les plus contaminées en arsenic total sont les produits issus de la mer (algues, puis poissons suivis des crustacés et mollusques). Néanmoins, l’arsenic y prédomine sous la forme d’arsénobétaïne et d’arsénoglucides, généralement peu toxiques. Certaines algues font exception, notamment l’algue brune Hijiki et la laminaire digitée [ 9 ] . A titre d’exemple, les avis successifs de l’Agence Européenne de Sécurité des Aliments (Efsa) en 2014 puis 2021 [ 10 ] ont en effet reporté une concentration moyenne d’arsenic inorganique de 11 mg/kg dans l’Hijiki [ 11 ]. Elle devance ainsi très largement le second aliment le plus contaminé en arsenic inorganique : le riz, particulièrement le riz rouge et le riz complet (contaminations moyennes respectives de 0,23 et 0,13 mg/kg selon les mêmes opinions Efsa). Cet exemple illustre l’intérêt de réaliser une analyse de spéciation de l’arsenic pour évaluer les risques liés à l’ingestion d’un aliment pour le consommateur. A noter que le BuSCA n°47 a récemment rapporté une étude sur la contamination en arsenic des riz dans le monde et les variations de spéciation selon les pratiques agronomiques. Plusieurs études ont également été publiées ces dernières années sur la réduction de la teneur en arsenic du riz en fonction du mode de cuisson [ 12 ; 13 ]
Le mercure (Hg) peut exister sous forme élémentaire, inorganique ou organique, la forme organique prédominante étant constituée de méthylmercure. Le mercure est principalement retrouvé chez les organismes aquatiques, en particuliers les grands poissons prédateurs tels que l’espadon et le requin dans lesquels il est biomagnifié. Le mercure inorganique est néphrotoxique, neurotoxique et peut entraîner des troubles cardiovasculaires. Le danger du méthylmercure réside essentiellement dans sa neurotoxicité, en particulier pendant la vie fœtale et la petite enfance. Le méthylmercure traverse beaucoup plus facilement la barrière hémato-encéphalique que les formes inorganiques en raison de sa forte liposolubilité. Les doses hebdomadaires tolérables établies par l’Efsa en 2018 diffèrent pour les deux formes : elles sont respectivement de 4 µg/kg pc/sem pour le mercure inorganique et de 1,3 µg/kg pc/sem pour le méthylmercure [ 14 ].
Le chrome (Cr) peut exister sous neuf états d’oxydation (de –II à + VI), néanmoins seuls le chrome trivalent Cr (III) et le chrome hexavalent Cr(VI) se rencontrent à l’état naturel. Le Cr(VI) présente par voie orale une toxicité 10 à 100 fois supérieure au Cr(III), dont le rôle dans la régulation du métabolisme des glucides, des lipides et des protéines et la fonction essentielle du Cr(III) dans le métabolisme n'ont pas été prouvés [ 15 ]. Une exposition aigüe au Cr(VI) s’accompagne d’effets respiratoires, hématologiques, hépatiques et rénaux. La cancérogénicité du Cr(VI) a été prouvée pour l’exposition par voie respiratoire (CIRC I [ 16 ]), mais n’est que suspectée pour la voie orale. En 2014, l’Efsa a rendu un avis sur l’exposition au chrome par l’alimentation et estimé que l’alimentation constitue un milieu réducteur qui favorise la prédominance du Cr(III), tandis que le Cr(VI) est la forme prépondérante dans l’eau destinée à la consommation humaine [ 17 ].
Si l’arsenic, le mercure et le chrome sont les trois ETM pour lesquels les analyses de spéciation apparaissent les plus indispensables, du fait des disparités de répartition dans les aliments ou des différences d’effets sanitaire et d’organes cibles selon les espèces, la toxicité d’autres éléments peut varier en fonction des formes de ceux-ci. Ainsi, pour l’ étain comme pour le plomb, les formes inorganiques, peu absorbées, sont moins toxiques que les formes organiques [ 18 ; 19 ]. Par exemple, la dose journalière tolérable établie par l’Efsa en 2004 [ 20 ] pour l’étain, sur la base d’une exposition à l’oxyde de tributylétain, est 3 000 fois plus faible que le niveau de risque minimum intermédiaire fixé par l’Agence pour le Registre des Substances Toxiques et des Maladies (ATSDR) pour une exposition de moins d’un an à l’étain inorganique (0,1 µg/kg pc/j contre 0,3 mg/kg pc/j). Dans les aliments, l’étain peut être présent sous forme organique ou inorganique dans des proportions variables tandis que le plomb inorganique est majoritaire [ 19 ], même si des formes organiques peuvent être retrouvées en des proportions importantes dans certaines espèces marines [ 21 ]. Inversement, le sélénium inorganique est considéré plus toxique que le sélénium organique, mais les preuves manquent chez l’Homme [ 22 ]. Le sélénium étant un oligo-élément essentiel, il est commercialisé sous forme de compléments alimentaires pour prévenir d’éventuelles carences. Son métabolisme étant dépendant des espèces en présence, il est important de pouvoir les caractériser pour éviter des surdosages [ 23 ].
Législation relative aux ETM dans les aliments et spéciation
Dans la majorité des cas, la législation relative à la teneur maximale en un ETM autorisée dans les denrées alimentaires cible la teneur totale. Il en est de même pour les limites de migration en ETM du matériau vers l’aliment. Quelques exceptions existent néanmoins :
- L’étain et l’arsenic pour lesquels les teneurs maximales autorisées sont fixées pour les formes inorganiques [ 24 ] ;
- Le chrome dont la limite de migration à partir des emballages ou produits d’emballage est fixée pour le chrome hexavalent (Cr(VI) [ 25 ].
Caractériser les formes chimiques
Les analyses de spéciation permettant une séparation, une détection et une quantification à des concentrations très faibles des ETM présents dans les matrices alimentaires sont des techniques assez complexes à optimiser et fiabiliser. L’une des principales difficultés porte sur la préparation en amont de l’échantillon afin de conserver à l’identique les espèces présentes dans la matrice, sans que celles-ci ne soient transformées au cours des différentes étapes de l’analyse. Cette préparation des échantillons implique, pour les matrices solides, des étapes d’extraction dites « douces », réalisées à partir de réactifs dilués sélectionnés en fonction de l’espèce chimique à isoler et du type de liaison la reliant à la matrice. De plus, une étape de dérivation peut être nécessaire, transformant des composés polaires en composés apolaires ensuite extraits dans un solvant apolaire, ce qui permet de séparer les espèces et de les concentrer. Les analyses de spéciation s’opèrent ensuite souvent en deux temps : une première étape de séparation, généralement réalisée par chromatographie en phase liquide (HPLC) ou gazeuse (GC), suivie d’une détection par spectrométrie atomique, le spectromètre de masse à plasma à couplage inductif (ICP-MS) étant très majoritairement utilisé pour ce type d’analyse à laquelle il garantit sensibilité et sélectivité. Il peut toutefois être difficile d’identifier les divers composés présents car, pour ce faire, les pics détectés en ICP-MS doivent être comparés à des profils d’étalons connus. Lorsque des profils ne correspondant pas aux étalons disponibles sont parfois retrouvés, il est alors nécessaire d’utiliser d’autres techniques de spectrométrie de masse (en tandem avec source d’ionisation par électrospray ou spectrométrie de masse moléculaire haute résolution) [Séby, Vacchina et Potin-Gautier, 2018]1 pour l’identification des formes organiques inconnues.
Peu de normes analytiques ont été établies pour réaliser l’analyse de spéciation d’un élément dans les denrées alimentaires. L’arsenic fût la première espèce concernée avec la fixation en 2008 d’une norme pour l’arsenic inorganique dans les algues (NF EN 15517), complétée par une seconde norme en 2016 pour l’arsenic inorganique dans les produits alimentaires d’origines marine et végétale (NF EN 16802). Une méthode normative a également été mise en place pour le méthylmercure dans les produits alimentaires d’origine marine en 2016 (NF EN 16801). En 2013, la norme NF EN 13804 : 2013 a établi des critères de performance pour les méthodes d'analyse des éléments et de leurs espèces chimiques dans les produits alimentaires.
Des besoins pour mieux comprendre le risque et améliorer la surveillance
En 2014, sur près de 80 000 données d’occurrence du chrome dans les aliments et l’eau de boisson collectées par l’Efsa auprès des Etats membres, seules 88 analyses de spéciation ont été fournies, toutes réalisées dans des eaux en bouteille [ 17 ]. De la même façon, l’avis de l’Efsa sur le mercure en 2018 n’a pu s’appuyer que sur un très faible nombre d’analyses pour lesquelles la spéciation avait été réalisée, des facteurs de conversion issus de la littérature ont donc été appliqués pour l’évaluation de risque [ 14 ]. Dans les avis Efsa sur le mercure, l’arsenic et le chrome (chrome, 2014 ; mercure, 2012 et 2018, arsenic, 2009 et 2021), des recommandations ont ainsi pointé le besoin de disposer de méthodes de spéciation validées avec une sensibilité adéquate et de plus de données de spéciation. En 2016, l’Etude de l’Alimentation Totale infantile (EATi), publiée par l’Anses, a également recommandé l’acquisition de données de spéciation pour l’arsenic dans les aliments infantiles, pour le chrome, l’étain, ainsi que le germanium et le vanadium [ 26 ].
Ainsi, même si l’analyse de spéciation des ETM fait l’objet d’un nombre de travaux de recherche croissant depuis les années 1970, il reste nécessaire de poursuivre l’acquisition de données toxicologiques, en particulier dans le domaine encore peu documenté de la toxicocinétique (bioaccessibilité, biodisponibilité) [ 27 ], et le développement de telles méthodes analytiques pour mieux évaluer les risques liés aux ETM dans les aliments et permettre de mieux surveiller ces dangers.
1. Séby, F.; Vacchina, V.; Potin-Gautier, M. Elements traces métalliques dans les aliments : importance de la spéciation. In Risques chimiques liés aux aliments; Camel, V. ; Rivière, G. ; Le Bizec, B.; Lavoisier: Paris, 2018; pp 497-517.